Pressmeddelande -
Att se det osynliga
Forskare vid Kemiska institutionen har lyckats kartlägga strukturen och funktionen hos ett flyktigt enzymtillstånd. Genom att modifiera enzymet adenylatkinas kunde forskarna isolera molekylen och studera den med de kvantitativa teknikerna röntgenkristallografi och kärnmagnetisk resonans spektroskopi (NMR). Resultaten är publicerade i tidskriften PNAS.
– Vi är nu ett steg närmare att på ett grundläggande sätt förstå hur enzymer fungerar. Detta är helt nödvändigt för framtida design av nya enzymer för bioteknologiska tillämpningar, säger Magnus Wolf-Watz, docent på Kemiska institutionen vid Umeå universitet.
Biologiskt liv är beroende av ett stort antal cellulära kemiska rektioner som i sig själva ofta är mycket långsamma och kan ta månader eller år. För att tidsskalorna för kemi och biologi ska vara i harmoni påskyndas kemiska reaktioner i celler med hjälp av enzymer som är effektiva biokatalysatorer.
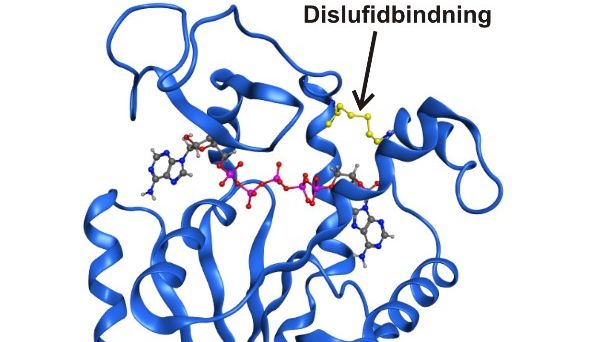
Under de senaste tio årens forskning har det stått klart att enzymstrukturer som bara existerar flyktigt och mycket kortvarigt kan vara helt nödvändiga för den katalytiska funktionen. Hittills har dessa tillstånd inte kunnat utforskas i detalj av den enkla anledningen att de är osynliga för traditionella spektroskopiska tekniker. Nu har forskare vid kemiska institutionen lyckats fånga ett flyktigt övergående tillstånd som är centralt för funktionen hos det livsnödvändiga enzymet adenylatkinas Det kortvariga tillståndet kunde fångas in och låsas genom att två aminosyror i enzymet byttes ut mot den reaktiva aminosyran cystein.
– Det är första gången som någon lyckats studera ett flyktigt enzymtillstånd direkt med spektroskopiska och kvantitativa tekniker. Med våra metoder kunde vi i detalj beskriva både strukturen och funktionen hos enzymet i det specifika flyktiga ögonblicket, säger Magnus Wolf-Watz som ledde studien tillsammans med postdoktor Michael Kovermann som nu är gruppledare vid Konstanz Universitet i Tyskland.
Resultaten visade att funktionen hos ett enzym är helt beroende av dess inneboende dynamik och utan dynamik skulle ett enzym vara stendött. Vidare visade det sig att det flyktiga tillståndet band sina substratmolekyler mycket starkare än det naturliga proteinet. Resultaten ger oss ytterligare pusselbitar i hur enzymer kan påskynda reaktioner med sådan oerhörd specificitet och effektivitet, och dessutom är metoden som vi utvecklat generellt användbar också i studier av andra enzymer.
Magnus Wolf-Watzs NMR-grupp har arbetat med studien tillsammans med röntgenkristallograferna Uwe H. Sauer och Elisabeth Sauer-Eriksson.
– Vi har haft ett långvarigt samarbete som har varit mycket produktivt. Detta är ett lyckat exempel på att den samarbetsvänliga atmosfären vid Umeå universitet är oerhört viktig och något vi ska slå vakt om och utveckla ännu mer i framtiden, säger Magnus Wolf-Watz.
Proteinforskning av högsta klass kan bedrivas vid Umeå universitet mycket tack vare de väl utvecklade kristallografi- och NMR-infrastrukturerna som etablerats med stöd från Kempestiftelserna. NMR-faciliteten är en del av den nationella NMR-infrastrukturen ”NMR for life”.
Originalartikel:
Kovermann M., Grundström C., Sauer-Eriksson E., Sauer H., och Wolf-Watz M.: Structural basis for ligand binding to an enzyme by a conformational selection pathway. DOI10.1073/pnas.1700919114
http://www.pnas.org/content/early/2017/05/24/1700919114.full
För mer information, kontakta gärna:
Magnus Wolf-Watz, Kemiska institutionen
Telefon: 0768-26 20 53
E-post: magnus.wolf-watz@umu.se
Pressbild för nedladdning. Foto: Mattias Pettersson
Ämnen
Regioner
Umeå universitet
Umeå universitet är ett av Sveriges största lärosäten med drygt 32 000 studenter och 4300 anställda. Här finns internationellt väletablerad forskning och en stor mångfald av utbildningar. Vårt campus utgör en inspirerande miljö som inbjuder till gränsöverskridande möten – mellan studenter, forskare, lärare och externa parter. Genom samverkan med andra samhällsaktörer bidrar vi till utveckling och stärker kvaliteten i forskning och utbildning.

