Pressemelding -
Almirall får EU-godkjennelse av EBGLYSS ® (lebrikizumab) for moderat til alvorlig atopisk dermatitt.
Lebrikizumab er et monoklonalt antistoff, som binder seg til IL-13 med høy affinitet og selektivt hemmer nedstrøms signalisering (1, 2, 3, 4). Lebrikizumab har vist tidlig klinisk effekt og vedvarende respons i opp til 2 år i både monoterapi og i kombinasjon med topikale kortikosteroider (5, 6, 7, 8). Tyskland er det første landet hvor lebrikizumab blir tilgjengelig som reseptpliktig medisin.
Almirall kunngjorde i dag at EU-kommisjonen har godkjent Ebglyss (lebrikizumab) for behandling av voksne og unge pasienter (12 år og eldre, med en kroppsvekt på minst 40 kg) med moderat til alvorlig atopisk dermatitt, som er kandidater for systemisk behandling. Legemiddelselskapet starter lanseringen i Tyskland, og fortsetter utrullingen i øvrige europeiske land i løpet av 2024.
Lebrikizumab er et monoklonalt antistoff som med høy affinitet binder seg til IL-13 (3,4) for å spesifikt forhindre dannelsen av IL-13Ra1/IL-4Ra heterodimer reseptor og påfølgende signalisering, (1,2,3,4) hvilket kraftig hemmer den biologiske virkningen av IL-13. IL-13 spiller en viktig rolle i atopisk dermatitt og driver den type-2 inflammatoriske syklusen i huden, som fører til dysfunksjon i hudbarrieren, kløe, hudfortykkelse og infeksjon. (2, 9, 10, 11, 12) Lebrikizumab har en selektiv virkningsmekanisme 2 og kliniske studier har vist dets effektivitet og sikkerhet, opprettholdt over perioder på opptil to år, 8 med en konsekvent vedlikeholdsdosering hver 4. uke fra uke 24.
– Godkjenningen av Ebglyss er gode nyheter for pasienter med atopisk dermatitt og helsepersonell som leter etter behandlinger med påvist kort- og langsiktig effekt, sikkerhet og pasientvennlig vedlikeholdsdosering. Denne behandlingen er et nytt alternativ for personer med moderat til alvorlig atopisk dermatitt og har potensiale til å bli en førstelinjebehandling, sier Christian Bruun-Andersen, administrerende direktør i Almirall Nordic, og legger til:
– Denne regulatoriske milepælen løfter også frem vårt ønske om å utvikle nye behandlinger, som utgjør en reell forskjell i livene til mennesker med hudsykdommer.
- De nye biologiske behandlinger markerer et paradigmeskifte i behandlingen av atopisk eksem, og godkjenningen av lebrikizumab representerer et betydelig sprang fremover i vår evne til å tilby pasientene en effektiv og veltolerert behandling. Dette gir oss ytterligere muligheter for å håndtere sykdommen og gjøre en positiv forskjell for pasienter med atopisk eksem, noe som gir nytt håp og forbedrede utsikter for deres liv og velvære, sier professor Christian Vestergaard, som er ansatt ved Hudavdelingen på Aarhus Universitetssykehus.
Godkjenningen er basert på tre avgjørende fase tre-studier inkludert ADvocate 1 og ADvocate 2, (7) som evaluerer lebrikizumab som monoterapi, og ADhere, som vurderer lebrikizumab i kombinasjon med topikale kortikosteroider (TCS), hos voksne og ungdom med moderat til alvorlig atopisk dermatitt. Lebrikizumab viste tidlig klinisk effekt i monoterapi ved uke 16, (5) og reduserte sykdomsomfang og alvorlighetsgrad med minst 75% (EASI-75) hos nesten 6 av 10 pasienter.
I kombinasjon med topikale kortikosteroider 6 ble EASI-75 oppnådd hos nesten 7 av 10 pasienter. Nesten 80% av respondentene* som fortsatte behandlingen med lebrikizumab i uke 16, både som monoterapi og i kombinasjon med TCS i opptil to år, opplevde vedvarende hudforbedring, lindring av kløe og redusert sykdomsgrad med vedlikeholdsdosering hver 4. uke (8)
Det kliniske utviklingsprogrammet i fase 3 evaluerte også sikkerhetsprofilen til lebrikizumab. De fleste bivirkninger var milde eller moderate i alvorlighetsgrad på tvers av studiene, og førte ikke til seponering av behandlingen. De vanligste bivirkningene var konjunktivitt, reaksjoner på injeksjonsstedet, allergisk konjunktivitt og tørre øyne.
Almirall har lisensiert rettighetene til å utvikle og kommersialisere lebrikizumab for behandling av dermatologiske indikasjoner – inkludert atopisk dermatitt – i Europa. Eli Lilly and Company har eksklusive rettigheter for utvikling og kommersialisering av produktet i USA og resten av verden. Dette gjelder ikke Europa. Almirall forventer regulatoriske beslutninger for lebrikizumab ved moderat til alvorlig atopisk dermatitt i flere europeiske markeder, inkludert Storbritannia og Sveits.
*) Respondentene er de som oppnådde en 75 % reduksjon i deres eksem iht. baseline målt med “Eczema Area and Severity Index” (EASI-75) eller en IGA 0 eller 1 ("klar" eller "nesten klar") med minst 2-punkts forbedring fra baseline og uten annen behandling ved uke 16. Ved uke 16 ble respondentene randomisert på nytt til lebrikizumab 250 mg annenhver uke/hver fjerde uke eller placebo i ytterligere 36 uker.
Om det kliniske utviklingsprogrammet for lebrikizumab
Lebrikizumab fase 3-studiene besto av fem globale studier som evaluerte over 1.300 pasienter, inkludert to monoterapistudier (ADvocate 1 og 2), en kombinasjonsstudie med topisk kortikosterioder (ADhere), samt en studie med langtidsoppfølging (ADjoin) og en åpent label-studie med ungdom (ADore).
Om atopic dermatitt (AD)
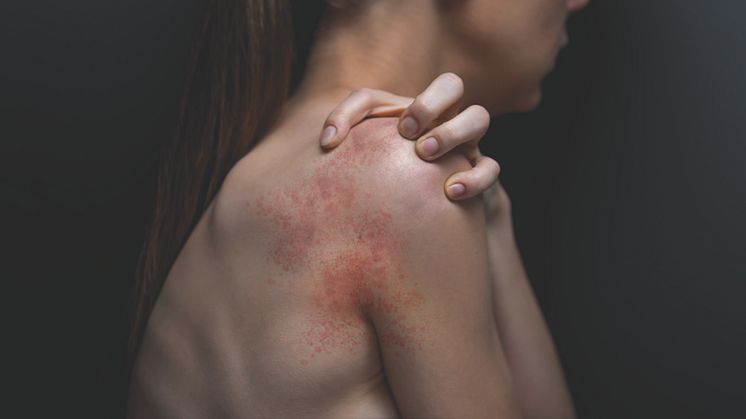
AD i er en inflammatorisk, kronisk hudsykdom, karakterisert ved tilbakevendende betennelsestilstand i huden med kløe eller kraftig kløe. I tillegg til fysiske symptomer som tørrhet, kløe, rødt utslett og betennelse, har AD også store emosjonelle konsekvenser for pasientene som kan innvirke på utdanning, sosialt og yrkesliv. 14 Med en anslått prevalens på opp til 4,4% blant voksne i EU har forekomsten av AD steget de seneste årtier. 20-30% av pasientene har AD i moderat til stor grad (14,15,16,17).
Mediekontakt
Christian Bruun-Andersen
General Manager, Almirall Nordics
christian.bruun-andersen@almirall.com
Mobil: (+45) 31 62 83 53
Links til Almirall
Almirall Nordics https://nordics.almirall.com
Almirall, S.A. www.almirall.com
Almiralls presserum www.almirall.com/media
About Almirall
Almirall is a global biopharmaceutical company focused on medical dermatology. We collaborate with scientists and healthcare professionals to address patients' needs through science to improve their lives. Our Noble Purpose is at the core of our work: "Transform the patients' world by helping them realize their hopes and dreams for a healthy life". We invest in differentiated and ground-breaking medical dermatology products to bring our innovative solutions to patients in need.
The company, founded in 1944 and headquartered in Barcelona, is publicly traded on the Spanish Stock Exchange (ticker: ALM). Throughout its 79-year history, Almirall has focused intensely on patients' needs. Almirall has a direct presence in 21 countries and strategic agreements in over 70, with about 1,800 employees. Total revenue in 2022 was €878.5 MM.
Legal warning
This document includes only summary information and is not intended to be exhaustive. The facts, figures and opinions contained in this document, in addition to the historical ones, are "forward-looking statements". These statements are based on the information currently available and the best estimates and assumptions that the company considers reasonable. These statements involve risks and uncertainties beyond the control of the company. Therefore, actual results may differ materially from those declared by such forward-looking statements. The company expressly waives any obligation to revise or update any forward-looking statements, goals or estimates contained in this document to reflect any changes in the assumptions, events or circumstances on which such forward-looking statements are based, unless required by the applicable law.
Kilder
1. Moyle M, et al. Understanding the immune landscape in atopic dermatitis: The era of biologics and emerging therapeutic approaches. Exp Dermatol. 2019 Jul;28(7):756-68.
2. Gonçalves F, et al. Selective IL-13 inhibitors for the treatment of atopic dermatitis. Drugs Context 2021;10:2021-1-7.
3. Okragly A, et al. Binding, Neutralization and Internalization of the Interleukin-13 Antibody, Lebrikizumab. Dermatol Ther (Heidelb). 2023;13(7):1535-1547.
4. Ultsch M, et al. Structural Basis of Signaling Blockade by Anti-IL-13 Antibody Lebrikizumab. J Mol Biol. 2013;425(8):1330-1339.
5. Silverberg JI, et al. Two Phase 3 Trials of Lebrikizumab for Moderate-to-Severe Atopic Dermatitis. N Engl J Med. 2023 Mar 23;388(12):1080-91.
6. Simpson EL, et al. Efficacy and Safety of Lebrikizumab in Combination With Topical Corticosteroids in Adolescents and Adults With Moderate-to-Severe Atopic Dermatitis: A Randomized Clinical Trial (ADhere). JAMA Dermatol. 2023 Feb 1;159(2):182-91
7. Blauvelt A, et al. Efficacy and safety of lebrikizumab in moderate-to-severe atopic dermatitis: 52-week results of two randomized double-blinded placebo-controlled phase III trials. Br J Dermatol. 2023 May 24;188(6):740-8. https://doi.org/10.1093/bjd/lj...
8. Guttman-Yassky E, et al. Efficacy and Safety of Lebrikizumab Is Maintained to Two Years in Patients With Moderate-to- Severe Atopic Dermatitis . 2023 Fall Clinical Dermatology Conference. 20th October, 2023.
9. Tsoi LC, et al. Atopic Dermatitis Is an IL-13-Dominant Disease with Greater Molecular Heterogeneity Compared to Psoriasis. J Invest Dermatol. 2019;139(7):1480-1489.
10. Bieber T. Interleukin-13: Targeting an underestimated cytokine in atopic dermatitis. Allergy. 2020 Jan;75(1):54-62.
11. Napolitano M, et al. The hidden sentinel of the skin: An overview on the role of interleukin-13 in atopic dermatitis.Front Med (Lausanne). 2023;10:1165098.
12. Bernardo D, et al. Lebrikizumab for the Treatment of Moderate-to-Severe Atopic Dermatitis. Am J Clin Dermatol. 2023;24, 753–764.
13. EBGLYSS (lebrikizumab). EU Summary of Product Characteristics.
14. Koszorú K, Borza J, Gulácsi L, Sárdy M. Quality of life in patients with atopic dermatitis. Cutis. 2019 Sep;104(3):174-177.
15. Barbarot S, et al. Epidemiology of atopic dermatitis in adults: Results from an international survey. Allergy. 2018 Jun;73(6):1284-93.
16. Silverberg J, et al. Atopic dermatitis in the pediatric population: A cross-sectional, international epidemiologic study. Ann Allergy Asthma Immunol 2021;126(4):417-428.
17. Munera-Campos M, et al. Innovation in Atopic Dermatitis: From Pathogenesis to Treatment. Actas Dermosifiliogr. 2020;111(3):205-221.
NOR-NOP-2300020