Pressmeddelande -
Almirall får EU-godkännande av EBGLYSS® (lebrikizumab) för behandling av måttlig till svår atopisk dermatit
Lebrikizumab är en monoklonal antikropp som binder till IL-13 med hög affinitet och selektivt hämmar nedströms signalering (1-4). Lebrikizumab har visat tidig klinisk effekt och bibehållen respons i upp till 2 år, både som monoterapi och i kombination med topikala kortikosteroider (5-8). Tyskland är det första landet där lebrikizumab kommer att finnas tillgängligt för förskrivning.
Almirall, ett globalt läkemedelsföretag inriktat på medicinsk dermatologi, meddelade idag att Europeiska kommissionen (EC) har godkänt lebrikizumab för behandling av vuxna och ungdomar (12 år och äldre med en kroppsvikt på minst 40 kg) med måttlig till svår atopisk dermatit (AD), som är kandidater för systemisk behandling. Direkt efter tillkännagivandet av EU-kommissionens godkännande kommer Almirall att inleda den kommersiella lanseringen i Tyskland. Under 2024 kommer företaget att fortsätta lanseringen i flera europeiska länder.
Lebrikizumab är en monoklonal antikropp som binder till cytokinet interleukin-13 (IL-13) med hög affinitet för att specifikt förhindra bildandet av IL-13Rα1/IL-4Rα heterodimer-komplexet och den efterföljande signaleringen, och därmed hämma de biologiska effekterna av IL-13 (3,4) IL-13 har en viktig roll vid atopisk dermatit och driver den typ 2-inflammatoriska kaskaden i huden, vilket leder till försämrad hudbarriär, klåda, förtjockad hud och infektioner (2,9-12). Lebrikizumab har en selektiv verkningsmekanism, 2 dokumenterad kort- och långsiktig effekt och säkerhet visad upp till 2 år (8) samt underhållsdosering var fjärde vecka för alla patienter efter vecka 24 (13).
“Godkännandet av lebrikizumab är goda nyheter för patienter med atopisk dermatit (AD) och för vårdpersonal som letar efter behandlingar med bevisad effekt på kort och lång sikt, säkerhet och patientvänlig underhållsdosering. Behandlingen innebär ett nytt alternativ för individer med måttlig till svår AD och har potential att bli en förstahandsbehandling,” säger Christian Bruun-Andersen, vd för Almirall i Norden. "Denna regulatoriska milstolpe förtydligar också vårt engagemang för att ta fram nya behandlingar som gör verklig skillnad för de som lever med hudsjukdomar,” tillägger han.
Om de kliniska studierna med lebrikizumab
Godkännandet baseras på tre pivotala fas 3-studier, inklusive ADvocate 1 och ADvocate 2 (5,7) , som har utvärderat lebrikizumab som monoterapi, och ADhere, som har testat lebrikizumab i kombination med topikala kortikosteroider (TCS) hos vuxna och ungdomar med måttlig till svår atopisk dermatit. Lebrikizumab visade tidig klinisk effekt i monoterapi vid vecka 16 (5) genom att det minskade sjukdomens omfattning och svårighetsgrad med minst 75% (EASI-75) hos nästan 6 av 10 patienter. I kombination med topikala kortikosteroider (6) uppnåddes detta hos nästan 7 av 10 patienter. Nästan 80 % av de som svarade på lebrikizumab i vecka 16* och som fortsatte behandlingen med lebrikizumab både som monoterapi och i kombination med TCS i upp till två år, upplevde bibehållen symtomfrihet, minskad klåda och minskad svårighetsgrad av sjukdomen med underhållsdosering var fjärde vecka (8)
I det kliniska utvecklingsprogrammet, fas 3, utvärderades även säkerhetsprofilen för lebrikizumab. De flesta biverkningarna i studierna var milda eller måttliga i svårighetsgrad och ledde inte till behandlingsavbrott. De vanligaste biverkningarna var konjunktivit, reaktioner vid injektionsstället, allergisk konjunktivit och torra ögon.
Almirall har licensierat rättigheterna att utveckla och kommersialisera lebrikizumab för behandling av dermatologiska indikationer, inklusive atopisk dermatit, i Europa. Eli Lilly har exklusiva rättigheter för utveckling och kommersialisering av produkten i USA och resten av världen, exklusive Europa. Almirall förväntar sig regulatoriska beslut för lebrikizumab vid måttlig till svår atopisk dermatit på ytterligare europeiska marknader, inklusive Storbritannien och Schweiz.
*Svarande definierades som de som uppnådde 75% minskning av Eczema Area and Severity Index från baslinjen (EASI-75) eller med IGA 0 eller 1 ("symtomfri" eller "nästan symtomfri") med minst 2 poängs förbättring och utan användning av akutmedicinering vid vecka 16. Vid vecka 16 randomiserades de som svarade på behandlingen till lebrikizumab 250 mg varannan eller var fjärde vecka eller placebo under ytterligare 36 veckor.
Om det kliniska utvecklingsprogrammet för lebrikizumab
Fas 3-programmet för lebrikizumab bestod av fem globala studier där fler än 1 300 patienter utvärderades. De studier som ingick var: två monoterapistudier (ADvocate 1 och 2), en kombinationsstudie med topikala kortikosteroider (ADhere), en studie med långtidsuppföljning (ADjoin) samt en öppen ungdomsstudie (ADore).
Om atopisk dermatit
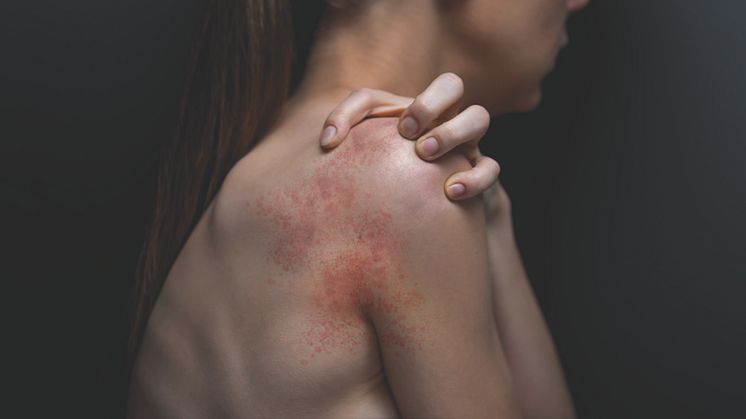
AD är en kronisk inflammatorisk hudsjukdom som kännetecknas av återkommande inflammation i huden med intensiv klåda. Utöver de uppenbart fysiska manifestationerna som torrhet, klåda, rodnad och inflammation kan detta tillstånd avsevärt påverka livskvaliteten negativt, samt påverka de drabbades akademiska, sociala och yrkesmässiga liv. Med en uppskattad prevalens på upp till 4,4% bland vuxna i EU verkar förekomsten av AD ha ökat under de senaste decennierna. 20-30% av patienterna har måttlig till svår AD (14-17).
Presskontakt
Christian Bruun-Andersen
VD Almirall Nordics
christian.bruun-andersen@almirall.com
Mobil: (+45) 31 62 83 53
About Almirall
Almirall is a global biopharmaceutical company focused on medical dermatology. We collaborate with scientists and healthcare professionals to address patients' needs through science to improve their lives. Our Noble Purpose is at the core of our work: "Transform the patients' world by helping them realize their hopes and dreams for a healthy life". We invest in differentiated and ground-breaking medical dermatology products to bring our innovative solutions to patients in need.
The company, founded in 1944 and headquartered in Barcelona, is publicly traded on the Spanish Stock Exchange (ticker: ALM). Throughout its 79-year history, Almirall has focused intensely on patients' needs. Almirall has a direct presence in 21 countries and strategic agreements in over 70, with about 1,800 employees. Total revenue in 2022 was €878.5 MM.
Legal warning
This document includes only summary information and is not intended to be exhaustive. The facts, figures and opinions contained in this document, in addition to the historical ones, are "forward-looking statements". These statements are based on the information currently available and the best estimates and assumptions that the company considers reasonable. These statements involve risks and uncertainties beyond the control of the company. Therefore, actual results may differ materially from those declared by such forward-looking statements. The company expressly waives any obligation to revise or update any forward-looking statements, goals or estimates contained in this document to reflect any changes in the assumptions, events or circumstances on which such forward-looking statements are based, unless required by the applicable law.
______________________________
1) Moyle M, et al. Understanding the immune landscape in atopic dermatitis: The era of biologics and emerging therapeutic approaches. Exp Dermatol. 2019 Jul;28(7):756-68.
2) Gonçalves F, et al. Selective IL-13 inhibitors for the treatment of atopic dermatitis. Drugs Context 2021;10:2021-1-7.
3) Okragly A, et al. Binding, Neutralization and Internalization of the Interleukin-13 Antibody, Lebrikizumab. Dermatol Ther (Heidelb). 2023; 13(7): 1535-1547.
4) Ultsch M, et al. Structural Basis of Signaling Blockade by Anti-IL-13 Antibody Lebrikizumab. J Mol Biol. 2013;425(8):1330-1339.
5) Silverberg JI, et al. Two Phase 3 Trials of Lebrikizumab for Moderate-to-Severe Atopic Dermatitis. N Engl J Med. 2023 Mar 23;388(12):1080-91.
6) Simpson EL et al. Efficacy and Safety of Lebrikizumab in Combination With Topical Corticosteroids in Adolescents and Adults With Moderate-toSevere Atopic Dermatitis: A Randomized Clinical Trial (ADhere). JAMA Dermatol. 2023 Feb 1;159(2):182-91
7) Blauvelt A, et al. Efficacy and safety of lebrikizumab in moderate-to-severe atopic dermatitis: 52-week results of two randomized double-blinded placebo-controlled phase III trials. Br J Dermatol. 2023 May 24;188(6):740-8.
8) Guttman-Yassky E, et al. Efficacy and Safety of Lebrikizumab Is Maintained to Two Years in Patients With Moderate-to-Severe Atopic Dermatitis. 2023 Fall Clinical Dermatology Conference. 20th October, 2023.
9) Tsoi LC, et al. Atopic Dermatitis Is an IL-13-Dominant Disease with Greater Molecular Heterogeneity Compared to Psoriasis. J Invest Dermatol. 2019;139(7):1480-1489.
10) Bieber T. Interleukin-13: Targeting an underestimated cytokine in atopic dermatitis. Allergy. 2020 Jan;75(1):54-62.
11) Napolitano M, et al. The hidden sentinel of the skin: An overview on the role of interleukin-13 in atopic dermatitis. Front Med (Lausanne). 2023;10:1165098.
12) Bernardo D, et al. Lebrikizumab for the Treatment of Moderate-to-Severe Atopic Dermatitis. Am J Clin Dermatol. 2023;24, 753–764.
13) EBGLYSS (lebrikizumab). EU Summary of Product Characteristics.
14) Koszorú K, Borza J, Gulácsi L, Sárdy M. Quality of life in patients with atopic dermatitis. Cutis. 2019 Sep;104(3):174-177.
15) Barbarot S, et al. Epidemiology of atopic dermatitis in adults: Results from an international survey. Allergy. 2018 Jun;73(6):1284-93.
16) Silverberg J, et al. Atopic dermatitis in the pediatric population: A cross-sectional, international epidemiologic study. Ann Allergy Asthma Immunol 2021;126(4):417-428.
17) Munera-Campos M, et al. Innovation in Atopic Dermatitis: From Pathogenesis to Treatment. Actas Dermosifiliogr. 2020;111(3):205-221.
NOR-NOP-2300019