Pressmeddelande -
Templerande S100A9-amyloider på Afi-fibrillarytor avslöjade genom laddningsdetektionsmasspektrometri, mikroskopi, kinetisk och mikrofluidisk analys
En forskargrupp har kartlagt proteinsamlings-aggregering i Alzheimers sjukdom. Templeringsmekanismen för S100A9-amyloider på A-fibrillarytor under sam-aggregeringsprocessen avslöjades genom synergi av biofysiska metoder inkluderande laddetekteringsmasspektrometri, mikroskopi, kinetisk och mikrofluidisk analys.
Amyloidbildning är av stor klinisk betydelse eftersom denna process är inblandad i flera neurodegenerativa sjukdomar såsom Alzheimers, Parkinsons och andra. Dessa sjukdomar drabbar miljoner av den åldrande befolkningen över hela världen. Ofta är det svårt att dra gränsen mellan dessa sjukdomar, eller så kan de uppstå samtidigt.
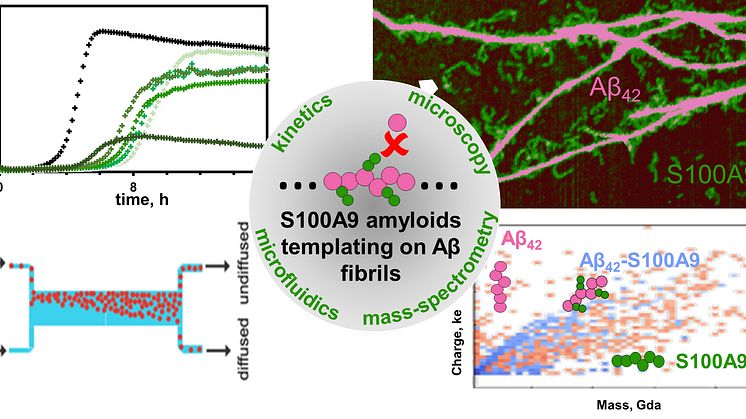
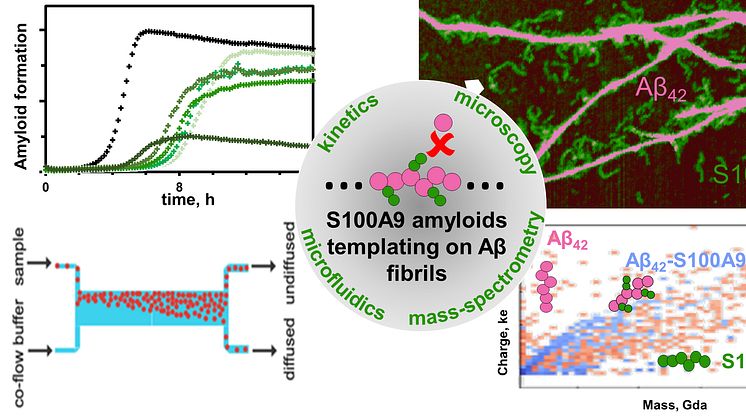
Medan amyloidbildningsförfarandet har studerats omfattande, är lite känt om de specifika mekanismerna för samaggregering av olika amyloidarter tillsammans, som ligger till grund för sjukdomarnas samsjuklighet. Vid Alzheimers sjukdom manifesteras den amyloid-neuroinflammatoriska kaskaden i samaggregering av AP med proinflammatoriskt S100A9-protein, vilket leder till intracellulär och extracellulär amyloid-sammansättning, amyloidplackavsättningar och celltoxicitet. Att dechiffrera interaktioner mellan proinflammatoriskt S100A9-protein och Aβ42-peptid vid Alzheimers sjukdom är grundläggande eftersom inflammation spelar en central roll i sjukdomens början. Forskarna använde innovativ ladddetektionsmasspektrometri, CDMS, tillsammans med biofysiska tekniker för att ge mekanistisk insikt i sam-aggregeringsprocessen och differentiera amyloidkomplex på en enda partikelnivå.
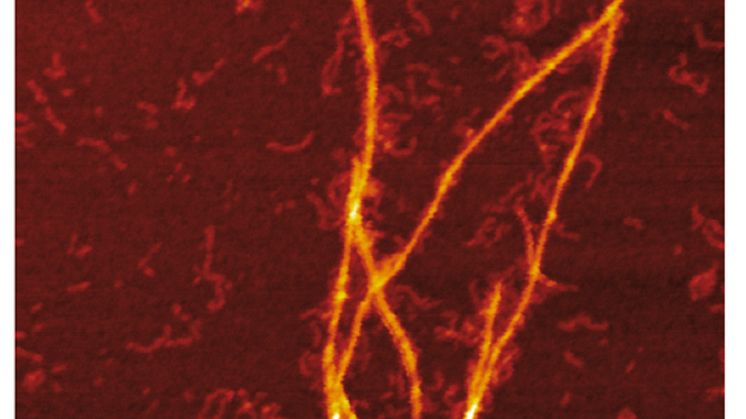
Kombination av mass- och laddningsfördelningar av amyloider tillsammans med rekonstruktion av skillnaderna mellan dem och detaljerad mikroskopi avslöjar att samaggregering innefattar templering av S100A9-fibriller på ytan av Aβ42-amyloider. Kinetisk analys bekräftar vidare att ytorna som är tillgängliga för den sekundära kärnbildningen av Aβ42 minskas på grund av beläggning med S100A9-amyloider, medan bindningen av S100A9 till Aβ42-fibriller valideras med en mikrofuidisk analys. Forskarna visar att synergi mellan CDMS, mikroskopi, kinetiska och mikrofuidiska anayser öppnar nya riktningar inom tvärvetenskaplig forskning.
Forskningen är genomförd i nära internationellt samarbete under ledning av Ludmilla A. Morozova-Roche vid Umeå universitet och inbegrep också laboratorierna vid Rodolphe Antoine i Institut Lumière Matière, Lyon, Frankrike, Thuomas Knowles, University of Cambridge , Storbritannien och Vytautas Smirnovas, Vilnius universitet, Litauen.
Studien är publicerad i den vetenskapliga tidskriften Chemical Science, där den även har fått plats i deras Hot article collection.
Om den vetenskapliga publiceringen
Templating S100A9 amyloids on Aβ fibrillar surfaces revealed by charge detection mass spectrometry, microscopy, kinetic and microfluidic analyses
Jonathan Pansieri, Igor A. Iashchishyn, Hussein Fakhouri, Lucija Ostojić, Mantas Malisauskas,a Greta Musteikyte, Vytautas Smirnovas, Matthias M. Schneider, Tom Scheidt, Catherine K. Xu, Georg Meisl, Tuomas P. J. Knowles, Ehud Gazit, Rodolphe Antoine, Ludmilla A. Morozova-Roche
Chemical Science
https://doi.org/10.1039/C9SC05905A
Kontakt:
Ludmilla Morozova-Roche
Professor, Institutionen för medicinsk kemi och biofysik
Telefon: 090-786 52 83
E-post: ludmilla.morozova-roche@umu.se
Igor Iashchishyn
Förste forskningsingenjör, Institutionen för medicinsk kemi och biofysik
Telefon: 070-751 63 15
E-post: igor.iashchishyn@umu.se
Bilder: Jonathan Pansieri
Ämnen
Regioner
Umeå universitet
Umeå universitet är ett av Sveriges största lärosäten med drygt 33 000 studenter och 4 000 anställda. Här finns internationellt väletablerad forskning och en stor mångfald av utbildningar. Vårt campus utgör en inspirerande miljö som inbjuder till gränsöverskridande möten – mellan studenter, forskare, lärare och externa parter. Genom samverkan med andra samhällsaktörer bidrar vi till utveckling och stärker kvaliteten i forskning och utbildning.