Pressmeddelande -
Proteiner hittar rätt med adresslapp och guide
De flesta nytillverkade proteiner i cellen måste förflyttas till rätt plats innan de kan sättas i arbete. För att proteinerna ska hitta rätt har de inbyggda signaler kopplade till sig, en slags adresslapp. Dessutom tar de hjälp av en partikel som guidar dem genom cellmembranet. I en ny studie publicerad i tidskriften Nature Structural and Molecular Biology visar forskare vid Umeå universitet hur detta samspel fungerar.
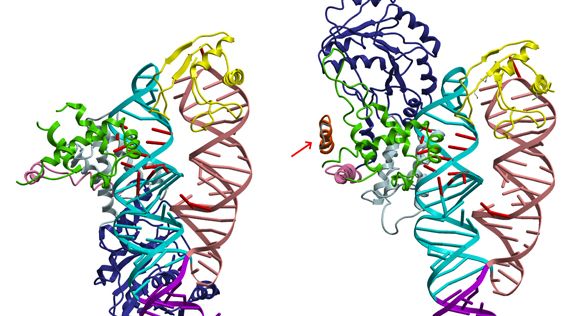
Bildtext: Strukturen av SRP utan adresslapp, det vill säga signalsekvens (till vänster) samt med signalsekvens (till höger). Signalsekvensen är markerad med en röd pil.
Det finns beräkningar som visar att varje mänsklig cell innehåller omkring en miljard proteinmolekyler. Med andra ord – det är trångt i cellen och det gäller att hålla ordning. Nytillverkade proteiner ska dessutom ofta förflyttas från platsen där de tillverkas till den plats där de ska utföra sina uppgifter. Dessa proteiner har en slags adresslapp, en signalsekvens, som specificerar till vilken plats i eller utanför cellen de ska transporteras. Transporten måste fungera felfritt för att skapa och behålla ordningen i cellen, men även för att cellen ska kunna kommunicera med sin omgivning. Om ett protein hamnar på fel plats kan det leda till allvarliga sjukdomar som till exempel cystisk fibros.
Möjligheten till proteintransport är för de flesta proteiner direkt kopplad till funktionen av SRP – den signaligenkännande partikeln. SRP binder till signalsekvensen och guidar den och det tillhörande protein till och igenom cellmembranet. En viktig fråga för forskarna har varit hur samspelet mellan signalsekvensen och SRP fungerar i detalj.
Umeåforskarna har nu fått fram en detaljerad bild av det första steget i proteintransporten genom att studera ett komplex av en signalsekvens som är bundet till SRP. Tekniken de använt kallas röntgenkristallografi. Gruppen har i flera tidigare studier visat grundstrukturen för SRP. Tack vare detta kunde de nu göra en direkt jämförelse av SRP:s struktur med och utan den guidande signalsekvensen.
– Strukturförändringarna var betydligt större än vad som tidigare förutspåtts. De ger oss detaljerade förklaringar om vilken roll SRP har i proteintransporten. Struktur-bestämningarna kan även ligga till grund för en modell över hur SRP fungerar på olika nivåer under proteintransporten, berättar Elisabeth Sauer-Eriksson, professor vid kemiska institutionen.
Nu arbetar forskarna vidare med att ta reda på nästa steg i transportmekanismen. De vill till exempel ha svar på frågor om vad som får den bundna signalsekvensen att släppa taget om SRP och hur signalsekvensen, och proteinet den är kopplad till, kan förflyttas genom membranet.
Forskarna som genomfört studien tillhör Umeå universitets starka forskningsmiljö ”biologisk kemi” och Umeå Centre for Molecular Research, UCMR. Finansiärer för forskningsprojektet är Vetenskapsrådet, UCMR och Kempestiftelserna.
Om SRP
SRP är ett ribonukleotidproteinkomplex som består av RNA och flera proteinkomponenter. SRP är mycket konserverat i naturen och finns i alla levande organismer vilket pekar på att det har en fundamental roll för cellens uppbyggnad och funktion.
Originaltitel: Structural basis of signal-sequence recognition by the signal recognition particle
Författare: Tobias Hainzl, Shenghua Huang, Gitte Meriläinen, Kristoffer Brännström och Elisabeth Sauer-Eriksson
http://www.nature.com/nsmb/journal/vaop/ncurrent/abs/nsmb.1994.html
För ytterligare information, kontakta gärna:
Tobias Hainzl
Telefon: 090-786 5924
E-post: tobias.hainzl@chem.umu.se
Elisabeth Sauer-Eriksson
Telefon: 090-786 5923
Mobil: 070-6335320
E-post: elisabeth.sauer-eriksson@chem.umu.se

