Pressmeddelande -
Blincyto godkänt för behandling av MRD-positiv leukemi
EU-kommissionen har beslutat att utvidga indikationen för Blincyto till att inkludera behandling av ALL-patienter med MRD, Minimal Residual Disease – patienter som har ett fåtal leukemiceller kvar trots att kriterierna för komplett remission är uppfyllda och patienten inte längre uppvisar några symtom eller sjukdomstecken.
– Det faktum att EU-kommissionen nu för första gången godkänner ett läkemedel för behandling av MRD är ett hoppingivande tecken på en framväxande insikt om hur viktigt det är att behandla bort de sista cancercellerna, säger Per Bernell, hematolog och en av Sveriges främsta experter på ALL.
Det europeiska godkännandet grundas på data frånfas II-studien BLAST.
Varje år insjuknar strax över hundra personer i Sverige av akut lymfatisk leukemi, ALL, en typ av blodcancer där omogna vita blodkroppar förökar sig okontrollerat. ALL leder snabbt till döden om inte behandling sätts in. Sjukdomen drabbar i första hand barn och unga som tack vare bättre behandling ofta kan botas. Även vuxna kan insjukna och för dessa har behandling med cytostatika till en början ofta god effekt, men risken för återfall är högre och prognosen sämre.
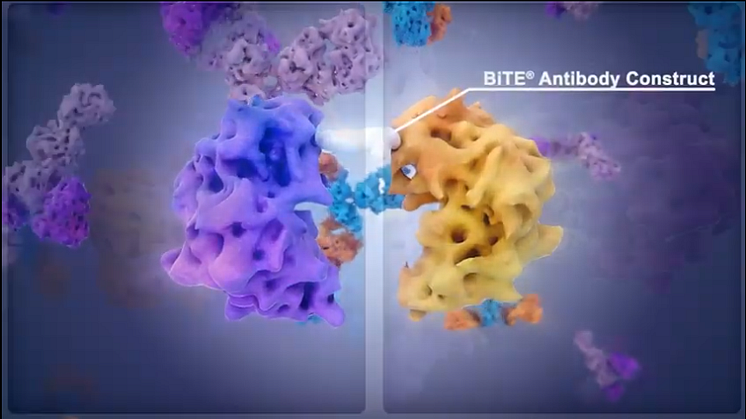
Blincyto (blinatumomab) är en så kallad BiTE-molekyl som som binder dels till CD19, en ytmarkör på B-celler, dels till CD3 som finns på T-celler, en typ av celler som spelar en central roll i immunförsvaret. Genom att koppla ihop leukemicellen med T-cellen stimulerar Blincyto T-cellerna att attackera de CD19-positiva leukemicellerna. Studier har visat att behandling med Blincyto vid ALL i många fall kan leda till komplett remission, ett tillstånd där patienten inte längre uppvisar några symtom eller sjukdomstecken.
Emellertid kan minimala spår av sjukdomen, MRD (minimal residual disease), finnas kvar även vid komplett remission, något som påtagligt ökar risken för återfall samtidigt som prognosen försämras betydligt. Det är mot denna bakgrund som EU-kommissionen nu beslutat att godkänna Blincyto för patienter som för första eller andra gången når komplett remission med 0,1 procent kvarvarande sjukdom eller mer.
– Överlevnaden bland patienter som uppnår MRD-negativitet, det vill säga att ingen MRD kan upptäckas, är signifikant bättre än för dem som fortfarande är MRD-positiva, säger Per Bernell. Detta understryker den kritiska betydelsen av tidig testning och eliminering av MRD hos patienter med ALL.
I fas II-studien BLAST behandlades 116 ALL-patienter som uppnått komplett hematologisk remission efter minst tre intensiva behandlingsblock med cytostatika men hade MRD på en nivå av 10^-3 eller högre. Efter en behandlingscykel med Blincyto hade 78 procent av patienterna uppnått komplett MRD-respons. Det innebär att ingen kvarvarande sjukdom kunde detekteras ens med PCR-teknik som är så känslig att den kan hitta en leukemicell bland 10 000 celler. I landmark-analyser hade patienter som uppnådde komplett MRD-respons längre tid utan återfall (23,6 mot 5,7 månader) och total överlevnad (38,9 mot 12,5 månader) jämfört med dem som inte nådde komplett MRD-respons.
Kort om Blincyto
Blincyto (blinatumomab) bygger på Amgens immunterapeutiska plattform BiTE, Bi-specific T cell Engager. Blincyto är ett bispecifikt antikroppskonstrukt som binder dels till CD19, en ytmarkör på B-celler, dels till CD3 som finns på T-celler, en typ av celler som spelar en central roll i immunförsvaret. I de allra flesta fall uttrycker leukemicellerna hos patienter med B-ALL CD19. Blincyto kopplar således ihop leukemicellen med T-cellen och på så sätt stimuleras T-cellerna att attackera de CD19-positiva leukemicellerna. Blincyto har i kliniska studier visats öka andelen patienter som uppnår fullständig remission/molekylär remission, vilket i sin tur är förknippat både med förlängd tid utan återfall och med förlängd total överlevnad. Vidare är det känt att patienter som genomgår stamcellstransplantation när de befinner sig i remission har påtagligt bättre chans att bli botade.
I november 2015 godkände EU-kommissionen Blincyto (blinatumomab) för behandling av vuxna med recidiverande eller refraktär Philadelphiakromosomnegativ CD19-positiv pre-B ALL. Hösten 2018 utvidgades indikationen till att även omfatta behandling av barn från ett års ålder.
Om BLAST
BLAST är den största prospektiva studien som genomförts på patienter med MRD-positiv ALL. Det är en öppen, multicenter-, enkelarms-, fas II-studie som utvärderar effekt, säkerhet och tolerabilitet av BLINCYTO hos vuxna patienter med MRD-positiv pre-B ALL vid komplett hematologisk remission efter tre eller flera cykler med intensiv kemoterapi. Patienterna i studien fick kontinuerlig IV-infusion med BLINCYTO 15 μg/m2/d under fyra veckor, följt av två veckor utan behandling. Patienterna fick upp till fyra behandlingscykler och kunde vid behov genomgå hematopoetisk stamcellstransplantation när som helst efter första cykeln. Det primära effektmåttet var andel som uppnådde icke detekterbar MRD inom en cykel av BLINCYTO-behandling och hematologisk återfallsfri överlevnad (RFS). De sekundära effektmåtten omfattade incidens och svårighetsgrad av biverkningar, total överlevnad (OS), tid till hematologisk remission och varaktighet av komplett MRD-respons.
Resultaten från BLAST har rapporterats av Nicola Gökbuget et al. i tidskriften Blood: Blinatumomab for minimal residual disease in adults with B-cell precursor acute lymphoblastic leukemia. På ASH 2018 presenterades uppföljningsdata: Blinatumomab for Minimal Residual Disease (MRD) in Adults with B-Cell Precursor Acute Lymphoblastic Leukemia (BCP-ALL): Median Overall Survival (OS) Is Not Reached in Complete MRD Responders at a Median Follow-up of 53.1 Months.
Säkerhet
Biverkningarna som beskrivs nedan har identifierats i kliniska studier på patienter med pre-B ALL (N = 843). De allvarligaste biverkningarna som kan uppstå vid behandling med blinatumomab inkluderar: infektioner (24,8%), neurologiska händelser (13,8%), neutropeni/febril neutropeni (10,1%), cytokinfrisättningssyndrom (3,3%) och tumörlysissyndrom (0,7%). De vanligast förekommande biverkningarna var: pyrexi (69,2%), infusionsrelaterade reaktioner (43,4%), infektioner med ospecificerad patogen (42,1%), huvudvärk (32,9%), anemi (22,8%), trombocytopeni (20,9%), febril neutropeni (20,2%), ödem (20,0%), neutropeni (19,7%), hudutslag (16,7%), förhöjda leverenzymer (16,1%), bakteriella infektioner (15,4%), tremor (15,2%), hosta (12,4%), leukopeni (13,4%), ryggsmärta (13,3%), frossa (13,0%), hypotension (12,8%), virusinfektioner (12,7%), minskad mängd immunglobuliner (12,5%), takykardi (11,3%), insomnia (10,7%), svampinfektion (10,6%) och smärta i extremiteter (10,2%). För ytterligare information om bland annat säkerhet, se internationellt pressmeddelande: European Commission Approves BLINCYTO® (blinatumomab) In Patients With Philadelphia Chromosome Negative Minimal Residual Disease-Positive B-cell Precursor Acute Lymphoblastic Leukemia .
För mer information, vänligen kontakta:
Maria Eriksson Svensson, medicinsk chef, Amgen, tel: 076–109 94 40