Pressmeddelande -
Lovande data på WCLC: möjlig behandling mot småcellig lungcancer
AMG 757, en DLL3-riktad BiTE-molekyl med förlängd halveringstid, visar lovande effekt mot småcellig lungcancer. Det visar nya fas I-data som presenteras vid World Conference on Lung Cancer.
– Resultaten talar för att AMG 757 har potential att bli ett meningsfullt behandlingsalternativ för patienter med denna svårbehandlade form av lungcancer, säger Salomon Tendler, MD, PhD, specialistläkare vid onkologiska kliniken på Karolinska Universitetssjukhuset och expert på småcellig lungcancer.
Småcellig lungcancer (SCLC) är en aggressiv neuroendokrin tumörsjukdom med hög återfallsrisk och dyster prognos. I Sverige diagnostiseras cirka 400 patienter per år med SCLC, vilket motsvarar en dryg tiondel av det totala antalet lungcancerfall. Medan framstegen inom behandling av icke-småcellig lungcancer har varit många och stora på senare år har utvecklingen varit betydligt mindre gynnsam vid småcellig lungcancer.
De behandlingar som finns att tillgå idag är huvudsakligen platinabaserade cytostatikaregimer som ger begränsad terapeutisk nytta. Därmed finns ett trängande behov av nya, mer effektiva behandlingsalternativ vid SCLC.
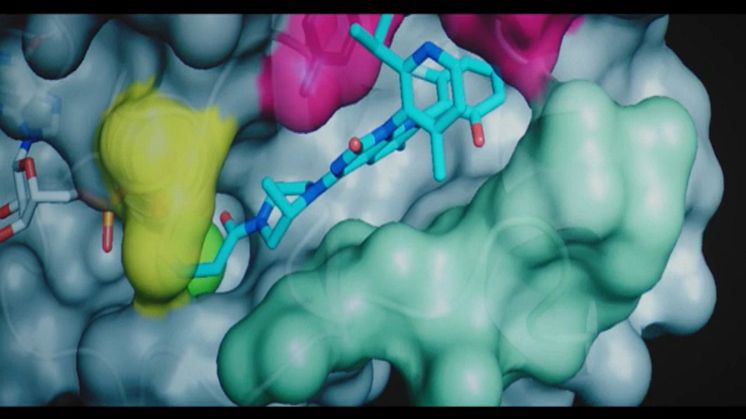
Vid World Conference on Lung Cancer som hölls 28–31 januari, i år virtuellt, presenteras hoppingivande data från en pågående fas I-studie som utvärderar AMG 757 vid småcellig lungcancer. AMG 757 är en så kallad BiTE-molekyl med förlängd halveringstid som binder bispecifikt, dels till DLL3, ett protein som överuttrycks på ytan av tumörceller vid SCLC, dels till CD3 på patientens egna T-celler. Effekten blir att T-cellernas cytotoxiska potential kanaliseras till att döda just de celler som överuttrycker DLL3, ett protein som uttrycks i ytterst liten utsträckning av normala celler.
Resultaten visar på en lovande antitumoral aktivitet. Närmare 16 procent av patienterna uppnådde bekräftad partiell respons (PR) medan nästan var tredje, 28,9 procent uppnådde stabil sjukdom.
– Med tanke på att utvecklingen inom behandlingen av småcellig lungcancer i det närmaste stått stilla de senaste decennierna, förutom små framsteg med immunoterapi, är det hoppingivande att patienter med SCLC stadium IV som har genomgått flera behandlingsomgångar svarar på AMG 757, säger Dr. Salomon Tendler som ägnat stora delar av sin forskning åt olika aspekter av småcellig lungcancer. Dessutom är det viktigt att poängtera att biverkningsprofilen tycks vara hanterbar I de flesta fallen.
Om studien
Study Evaluating Safety, Tolerability and PK of AMG 757 in Adults With Small Cell Lung Cancer (NCT03319940) är en first-in-human doseringsstudie med utvärdering av säkerhet och tolerans för AMG 757 vid SCLC som primärt effektmått. Studien syftar också till att bestämma den maximalt tolererade dosen eller den rekommenderade fas II-dosen av AMG 757. Sekundära effektmått inkluderade farmakokinetisk karakterisering och utvärdering av preliminär antitumöraktivitet. Därutöver utvärderades immunogenicitet, biomarkörer och målprotein.
I studien administrerades AMG 757 i åtta olika dosnivåer, 0,003–10,0 mg, intravenöst varannan vecka med/utan dosstegning. De 40 patienterna i studien (medianålder 64 år) hade SCLC som progredierade eller återkom efter ≥1 platinabaserad behandling. 17 av dem hade genomgått PD-1/PD-L1-behandling. Antitumoral aktivitet bedömdes med hjälp av modifierad RECIST 1.1. Tumör-DLL3-uttryck bedömdes genom immunhistokemi. T-cellsaktivering och cytokinprofiler utvärderades före och efter behandling med AMG 757.
Stabil sjukdom rapporterades för 11 (28,9%). En patient har pågående obekräftad PR i DL8. Utvärdering av DL8 pågår. Patienter med bekräftad PR hade en median på 2 (1–4) tidigare behandlingslinjer och svarstiden var 1,9+ till 9,4+ månader. DLL3-uttryck på vilken nivå som helst observerades i 31 av 32 (96,9%) patienttumörprover, med övergripande H-score 40–300. Tumörkrympning inträffade över ett brett spektrum av DLL3-uttryck (H-score, 55–300).
Medianbehandlingstiden var 6,1 veckor (0,1–59,4). Biverkningar inträffade hos 39 (97,5 procent) av patienterna, vilket resulterade i behandlingsavbrott hos fyra (10,0 procent). 32 (80,0 procent) av biverkningarna var behandlingsrelaterade, inklusive sju (17,5 procent) av grad ≥3 och en (2,5 procent) grad 5 (pneumonit). Cytokinfrisättningssyndrom (CRS) rapporterades hos 18 (45,0 procent) av patienterna. Fem patienter (12,5 procent) fick CRS av grad 2, inget fall av CRS grad ≥3 rapporterades. CRS, i första hand manifesterat som feber med eller utan hypotoni, var reversibelt och kunde hanteras med stödjande vård, kortikosteroider och/eller anti-IL-6-behandling.
Kort om BiTE
BiTE (bispecific T-cell engager) är Amgens plattform för målriktade immunoonkologiska terapier. BiTE-molekyler är uppbyggda av två olika antikroppsstrukturer: en som binder till CD3 som finns på T-celler, och en som binder till ett tumörspecifikt antigen, i detta fall DLL3 (delta-like ligand 3), vilket aktiverar den cytotoxiska potentialen hos T-celler för att eliminera detekterbar cancer.
Vissa BiTE-molekyler, däribland AMG 757, är dessutom half-life extended (HLE), vilket innebär att de är konstruerade på så vis att halveringstiden är förlängd och därmed kan utöva sin effekt under längre tid innan de elimineras från kroppen.
Mer information om BiTE-plattformen finns på AmgenBiTETechnology.com.
AMG 757 kommer även att prövas vid neuroendokrin prostatacancer, A Study of AMG 757 in Participants With Neuroendocrine Prostate Cancer.
För ytterligare information, vänligen kontakta:
Sandra Eketorp Sylvan, medicinsk chef, Amgen, tel: 070–433 57 91
Ämnen
Kategorier
Amgen är ett forskande läkemedelsföretag med fokus på att förbättra hälsan hos patienter med allvarliga sjukdomar. Vi bedriver forskning och utveckling av bioteknologiska originalläkemedel och biosimilarer inom terapiområdena onkologi, hematologi, osteoporos, inflammation, kardiologi och nefrologi. Globalt är vi över 25 000 medarbetare, varav cirka 110 arbetar i Sverige. Det svenska kontoret finns i Solna, Stockholm.