Pressmeddelande -
EU godkänner Cimzia vid behandling av reumatoid artrit
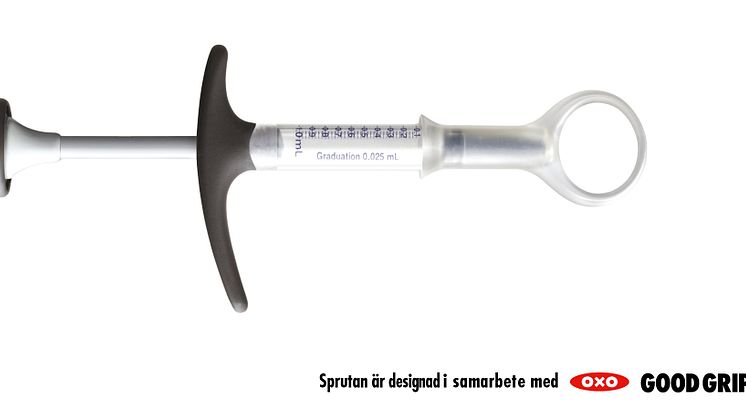
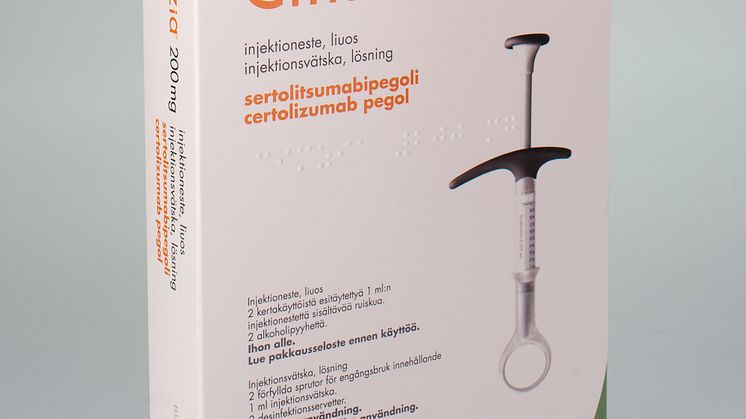
UCB meddelar idag att den europiska läkemedelsmyndigheten EMEA har godkänt Cimzia (certolizumab pegol) för behandling av patienter med måttlig till svår reumatoid artrit. Cimzia är den enda TNF-hämmare som består av ett pegylerat Fab-fragment av en antikropp. Cimzia ges med en förfylld spruta som är specialdesignad i samarbete med OXO Good Grips®.
Cimzia har i kombination med behandling med metotrexat visat sig stoppa nedbrytningen av lederna och öka patienternas rörlighet vid måttlig till svår reumatoid artrit (RA).
- Cimzia välkomnas både av patienter och läkare för ett ge patienter bättre möjligheter att behandla sjukdomen och uppnå ökad livskvalitet. Studier visar att Cimzia snabbt och effektivt minskar symtom som svullna och värkande leder, smärta och trötthet. Redan efter 16 veckor har Cimzia visat sig ha en bromsande effekt på den långsiktiga nedbrytningen av lederna, säger docent Ronald van Vollenhoven, överläkare vid reumatologkliniken på Karolinska Universitetssjukhuset Solna. Ronald van Vollenhoven är en av författarna till en av de publicerade huvudstudierna som ligger till grund för godkännandet.
Cimzia har blivit godkänt för att ges som en spruta i underhudsfettet (så kallad subkutan injektion). Cimzia levereras i en förfylld specialdesignad spruta framtagen i samarbete med OXO Good Grips®.
OXO Good Grips® specialiserar sig på att ta fram och designa innovativa produkter som gör vardagslivet enklare. UCB och OXO Good Grips® samarbete har resulterat i en ny design av den traditionella injektionssprutan. Målet har varit att underlätta för patienter att kunna ge sig själva injektioner. Sprutan är designad för att kunna användas av patienter med olika grepptekniker och styrka och den har visat sig ge mätbara förbättringar för patienterna. I år fick sprutan en internationell designutmärkelse för god design (1) och den har även blivit godkänd av svenska Reumatikerförbundet som en lätthanterlig produkt att använda (2).
Studieprogrammet (3, 4, 5, 6) bakom ansökan omfattar över 2 300 patienter med reumatoid artrit. Huvudstudierna RAPID 1 och RAPID 2 visar att Cimzia i kombination med metotrexat ger en signifikant förbättring av sjukdomssymtomen vid 52 (3) respektive 24 (4) veckors behandling, jämfört med de som behandlades enbart med metotrexat. Klinisk effekts erhölls redan efter första (ACR 20 respons*) respektive andra (ACR 50 respons*) veckan i de två studierna. I uppföljningen av RAPID 1 kvarstår den kliniska effekten avseende ACR 20/50/70* efter två år.
Röntgendata visar dessutom att Cimzia i kombination med metotrexat signifikant hämmar nedbrytningen av lederna vid 24 veckors behandling, jämfört med enbart metotrexat. Effekten bibehölls under 100 veckor (100 veckorsdata kommer från den förlängda studien av RAPID 1).
EU godkännandet avser behandling med Cimzia (certolizumab pegol) i kombination med standardbehandlingen metotrexat hos vuxna personer med en aktiv, måttlig till svår reumatoid artrit när andra sjukdomsmodifierande antireumatiska läkemedel (DMARDs), inklusive metotrexat, haft otillräcklig effekt. Cimzia kan ges som monoterapi vid intolerans mot metotrexat eller när fortsatt behandling med metotrexat är olämplig.
Om Cimzia
Cimzia är en ny generation TNF-hämmare och är det första godkända läkemedlet som består av enbart ett fragment av en antikropp. Cimzia är unik genom sin struktur med ett så kallat pegylerat Fab-fragment av en humaniserad antikropp. Cimzia är den enda pegylerade TNF-hämmaren. Pegyleringen gör att Cimziamolekylen stabiliseras och kan cirkulera längre i kroppen vilket ger möjlighet till en dosering varannan vecka.
- Vi vet idag att de olika TNF-hämmarna fungerar på olika sätt och att behandlingssvaret varierar stort mellan individer och här kan Cimzia bli ett värdefullt tillskott. Studieresultaten visar att Cimzia, en TNF-hämmare som bara består av ett fragment av en antikropp, kan ha samma effekt som hela antikroppar och teoretisk sett är förhoppningen att risken för biverkningar ska vara mindre, säger Ronald van Vollenhoven.
Cimzia rekommenderas att ges som en startdos om 400 mg (två injektioner samma dag på 200 mg) vecka 0, 2 och 4, följt av 200 mg som underhållsdos varannan vecka. Behandling med metotrexat ska fortsätta i de fall där det är lämpligt.
Allvarliga biverkningar som rapporterats i studieprogrammet för Cimzia är jämförbara med andra TNF-alfahämmare, dvs infektioner (tuberkulos) och malignitet (inklusive lymfom). De vanligaste rapporterade biverkningarna var olika typer av infektioner (virala, bakteriella och svamp) detta rapporterades hos 15,5 % av Cimziapatienterna jämfört med 7,6 % av patienterna som fick placebo). Påverkan på allmäntillståendet och lokala injektionsreaktioner rapporterades hos 10% av Cimzia patienterna jämfört med 9,7 % hos patienterna i placebogruppen.
En summering av säkerhetsdata visar att få patienter upplevde smärta vid injektionsområdet (1,5 %) eller avbröt behandlingen på grund av problem med biverkningar (5 %). Cimzia har uppvisat en gynnsam risk-nyttoprofil under minst två års behandlingsuppföljning.
Den amerikanska läkemedelsmyndigheten FDA godkände i april Cimzia för behandling vid måttlig till svår reumatoid artrit. Cimzia är sedan april 2008 godkänd för behandling vid måttlig till svår Crohns sjukdom i USA och godkändes i Schweiz i september 2007 för behandling av Crohns sjukdom. UCB har studerar även Cimzia vid behandling av andra inflammatoriska sjukdomar.
OXO® och GOOD GRIPS® är registrerade varumärken inom Helen of Troy Limited (NASDAQ HELE) och används under licens.
Om TNF
Vid reumatoid artrit angriper de egna immuncellerna lederna i kroppen och orsakar en inflammatorisk process. Behandlingen går ut på att försöka stoppa eller dämpa inflammationen som förstör patienternas leder.
TNF-hämmarna (tidigare även kallade TNF-alfahämmare) binder till ett specifikt protein i kroppen som kallas för tumörnekrosfaktor eller TNF, vilken har en nyckelroll vid inflammation. Ökad mängd TNF har en direkt koppling till inflammatoriska sjukdomar som reumatoid artrit, Crohns sjukdom, ulcerös kolit, psoriasisartrit och psoriasis.
För mer information
Docent Ronald van Vollenhoven, överläkare vid reumatologkliniken, Karolinska Universitetssjukhuset Solna, 08-517 760 77 eller 073-978 91 58, ronald.van.vollenhoven@ki.se
Britt Sundman-Engberg, medicinsk rådgivare immunologi, UCB, 0730-26 25 25, britt.sundmanengberg@ucb.com
Pressbilder och mer fakta och bakgrundsinformation finns på www.mynewsdesk.com/se/pressroom/ucb-pharma eller se relaterat material nedan i detta pressmeddelande.
Om OXO
OXO grundades 1990 med affärsidén att producera konsumentprodukter som förenklar tillvaron för sina användare. Från början tillhandahöll OXO ett 15-tal produkter, idag har OXO-kollektionen vuxit till mer än 800 artiklar och inkluderar produkter för matlagning, trädgårdsarbete, städning, förvaring och belysning.
OXO Good Grips produkter säljs idag i 54 länder och finns även att utställda på ett stort antal museer. Bolaget har vunnit mer än 100 designpriser över hela världen. OXO används också ofta som exempel på hur ett väl genomfört designkoncept kan vara en framgångsrik affärsstrategi.
OXO ägs av Helen of Troy Limited, ett ledande företag som bedriver design, produktion och marknadsföring av konsumentprodukter över hela världen. För ytterligare information: www.oxo.com
Om UCB
UCB är ett ledande globalt läkemedelsföretag inom biomedicin. Vi är hängivna forskning, utveckling och marknadsföring av innovativa läkemedel med fokus på områdena centrala nervsystemet och inflammatoriska sjukdomar. Försäljningen uppgick 2008 till 3,6 miljarder euro. UCB har sitt huvudkontor i Bryssel och finns representerat i mer än 40 länder. Företaget har över 10 000 anställda. UCB är börsnoterat (Euronext Brussels Exchange).
För ytterligare information: www.ucb.com samt www.inflammation.nu
UCB Pharma AB, Stureplan 4c, 114 35 Stockholm, UCB NORDIC A/S Arne Jacobsens Allé 15 DK - 2300 Köpenhamn S, Danmark
*Ordförklaringar
ACR (American Collage of Rheumatology) har utarbetade kriterier för att bedöma i vilken mån en patient blir bättre av behandling. Den viktigaste bedömningsgrunden är minskat antal angripna leder. ACR20=20-procentig förbättring, ACR50=50-procentig förbättring samt ACR70=70-procentig förbättring.
Referenser
1. "Red Dot Communication Design" award, www.en.red-dot.org, Se pressmeddelande från UCB den 12 augusti 2009, www.ucb.com
2. Easy to Use test of Cimzia, UCB, Performed by Unicum and Testkonsulenterna. On assignment from The Swedish Rheumatism Association, 16th and 17th of June 2009.
3. Keystone, E et al. Certolizumab pegol plus methotrexate is significantly more effective than placebo plus methotrexate in active rheumatoid arthritis: The RAPID 1 Study. Arthritis and Rheumatism 2008;58(11):3319-3329.
4. Smolen et al. Efficacy and safety of certolizumab pegol plus methotrexate in active rheumatoid arthritis: the RAPID 2 study. A randomised controlled trial. Ann Rheum Dis. 2009 June;68(6):797-804.
5. Keystone E et al. Sustained efficacy of certolizumab pegol added to methotrexate (MTX) in the treatment of rheumatoid arthritis (RA): 2-year results from the RAPID 1 trial. European League Against Rheumatism (EULAR), Copenhagen, Denmark, June 2009. AB 1609.
6. Keystone, E et al. A more rapid clinical response following certolizumab pegol treatment is associated with better 52-week outcomes in patients with rheumatoid arthritis. European League Against Rheumatism (EULAR), Copenhagen, Denmark, June 2009. AB 1522.
09-CZP-0079