Pressmeddelande -
Bristol Myers Squibb presenterar positiva resultat från två pivotala fas III-studier vid psoriasis, som visar signifikant bättre resultat för deucravacitinib jämfört med placebo och Otezla® (apremilast)
- Signifikant fler patienter som behandlades med deucravacitinib uppnådde PASI 75 och sPGA 0/1 vid vecka 16 jämfört med patienter som behandlades med placebo eller Otezla®(apremilast), skillnaderna i förbättring jämfört med Otezla ökade ytterligare vid vecka 24 och bibehölls upp till vecka 52.
- Deucravacitinib tolererades väl och antalet patienter som avbröt studien på grund av biverkningar var lågt.
- Deucravacitinib är en oral, selektiv tyrosinkinas 2 (TYK2)-hämmare med en unik verkningsmekanism.
- Resultaten presenteras som “late-breaking abstract” på American Academy of Dermatology 2021 Virtual Meeting Experience.
Bristol Myers Squibb presenterar positiva resultat från två pivotala fas III-studier som utvärderar deucravacitinib, en oral, selektiv tyrosinkinas 2 (TYK2)-hämmare, för behandling av patienter med måttlig till svår plackpsoriasis. Studierna POETYK PSO‐1 och POETYK PSO‐2, som utvärderade deucravacitinib 6 mg en gång dagligen, uppnådde de båda co-primära effektmåtten jämfört med placebo, då signifikant fler patienter som behandlades med deucravacitinib uppnådde Psoriasis Area and Severity Index (PASI) 75 och en static Physician Global Assessment-poäng (sPGA) för utläkt eller nästan utläkt hud efter 16 veckors behandling. Deucravacitinib tolererades väl och antalet patienter som avbröt studien till följd av biverkningar var lågt.
Deucravacitinib uppvisade i båda studierna signifikant bättre hudutläkning jämfört med Otezla på viktiga sekundära effektmått, mätt som PASI 75 och sPGA 0/1 vid vecka 16 och vecka 24. Resultaten inkluderar:
PASI 75-svar i studierna POETYK PSO‐1 och POETYK PSO‐2:
- Vid vecka 16 uppnådde 58,7% och 53,6% av patienterna som behandlades med deucravacitinib PASI 75, jämfört med 12,7% och 9,4% av patienterna som fick placebo samt 35,1% och 40,2% av patienterna som behandlades med Otezla.
- Vid vecka 24 uppnådde 69,0% och 59,3% av patienterna som behandlades med deucravacitinib PASI 75, jämfört med 38,1% och 37,8% av patienterna som behandlades med Otezla.
- Bland patienter som uppnådde PASI 75 vid vecka 24 med deucravacitinib och fortsatte behandlingen med deucravacitinib, bibehöll 82,5% respektive 81,4% PASI 75 vid vecka 52.
sPGA 0/1-svar i studierna POETYK PSO‐1 och POETYK PSO‐2:
- Vid vecka 16 uppnådde 53,6% och 50,3% av patienterna som behandlades med deucravacitinib sPGA 0/1-svar, jämfört med 7,2% och 8,6% av patienterna som fick placebo samt 32,1% och 34,3% av patienterna som behandlades med Otezla.
- Vid vecka 24 uppnådde 58,4% och 50,4% av patienterna som behandlades med deucravacitinib sPGA 0/1 jämfört med 31,0% och 29,5% av patienterna som behandlades med Otezla.
Signifikant bättre resultat med deucravacitinib jämfört med placebo och Otezla
Deucravacitinib uppvisade en robust effektprofil, inklusive signifikant bättre resultat jämfört med placebo på de co-primära effektmåtten och jämfört med Otezla på viktiga sekundära effektmått. Förutom PASI 75- och sPGA 0/1-värden var deucravacitinib signifikant bättre än Otezla i båda studierna på flertalet andra sekundära effektmått, vilket visade signifikanta och kliniskt betydelsefulla effektförbättringar på symtombelastning och livskvalitetsmått.
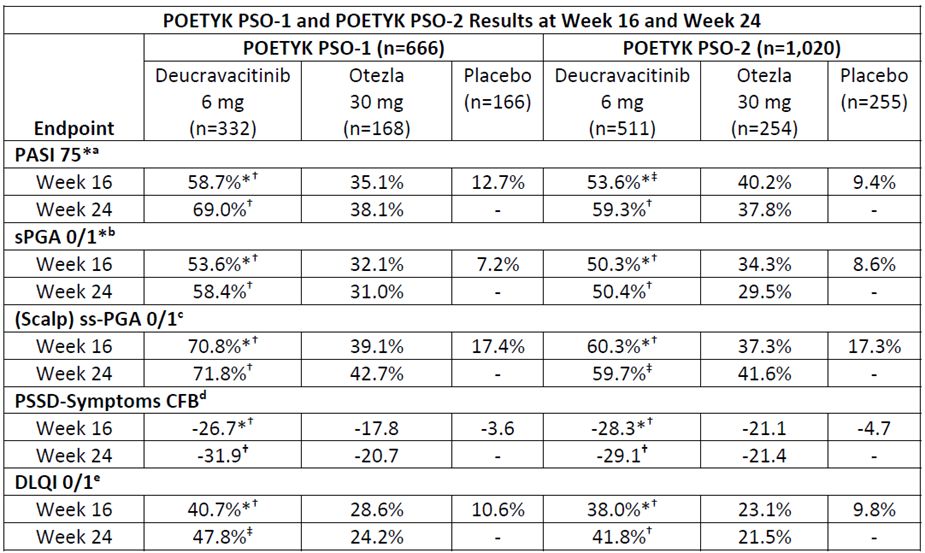
*Co-primära effektmått för POETYK PSO‐1 och POETYK PSO‐2 var PASI 75 och sPGA 0/1 för deucravacitinib vs placebo vid vecka 16.
a. PASI 75 definieras som en förbättring på minst 75% jämfört med baslinjen gällande Psoriasis Area and Severity Index (PASI)-poäng. *p<0.0001 vs placebo. †p<0.0001 vs Otezla. ‡p=0.0003 vs Otezla.
b. sPGA 0/1 definieras som static Physician’s Global Assessment-poäng (sPGA) för utläkt eller nästan utläkt hud. *p<0.0001 vs placebo. †p<0.0001 vs Otezla.
c. ss‐PGA 0/1 definieras som en skalp-specifik Physician’s Global Assessment-poäng (ss‐PGA) för utläkt eller nästan utläkt hud hos patienter med en ss‐PGA på minst 3 (måttlig) vid baslinjen. POETYK PSO‐1: *p<0.0001 vs placebo. †p<0.0001 vs Otezla. POETYK PSO‐2: *p<0.0001 vs placebo. †p<0.0001 vs Otezla. ‡p=0.0002 vs Otezla.
d. Förändring från baslinjen (CFB) enligt Psoriasis Symptoms and Signs Diary (PSSD) som mäter förbättring av symtomen klåda, smärta, sveda, stickningar och stram hud enligt patienternas digitala dagböcker (eDiaries). *p<0.0001 vs placebo. †p<0.0001 vs Otezla.
e. Dermatology Life Quality Index-poäng (DLQI) 0/1 uppmätte inte någon effekt alls på patienters livskvalitet hos patienter med en DLQI-poäng vid baslinjen ≥2. POETYK PSO‐1: *p<0.0001 vs placebo. †p=0.0106 vs Otezla. ‡p<0.0001 vs Otezla. POETYK PSO‐2: *p<0.0001 vs placebo. †p<0.0001 vs Otezla.
Säkerhet och tolerabilitet
Deucravacitinib tolererades väl och hade en liknande säkerhetsprofil i båda studierna. Vid vecka 16 upplevde 2,9% av 419 patienter med placebo, 1,8% av 842 patienter med deucravacitinib och 1,2% av 422 patienter med Otezla allvarliga biverkningar, sammanlagt i de båda studierna. De vanligaste biverkningarna i studierna (≥5% av patienterna) vid behandling med deucravacitinib vid vecka 16 var nasofaryngit och infektion i de övre luftvägarna, med låga frekvenser av huvudvärk, diarré och illamående. Vid vecka 16 upplevde 3,8% av patienterna med placebo, 2,4% av patienterna som behandlades med deucravacitinib och 5,2% av patienterna som behandlades med Otezla, biverkningar som ledde till studieavbrott. För de båda studierna POETYK PSO‐1 och POETYK PSO‐2 justerades allvarliga biverkningar för exponering under 52-veckorsperioden. Den exponeringsjusterade incidensen (händelser/100 patientår, EAIR) var 5,7 med placebo, 5,7 med deucravacitinib respektive 4,0 med Otezla. Under samma tidsperiod för de båda studierna var EAIR för biverkningar som ledde till studieavbrott 9,4 med placebo, 4,4 med deucravacitinib och 11,6 med Otezla. Inga nya säkerhetssignaler observerades under veckorna 16–52.
Under hela fas III-studieprogrammet var förekomsten/incidensen av maligniteter, allvarliga kardiovaskulära biverkningar (MACE), venös tromboembolism (VTE) och allvarliga infektioner generellt genomgående låg för alla aktiva behandlingsgrupper. Inga kliniskt meningsfulla förändringar observerades i flertalet laboratorieparametrar (inklusive anemi, blodkroppar, lipider och leverenzymer) under 52 veckor.
- Resultaten från båda dessa pivotala studier visar att deucravacitinib, en oral, selektiv TYK2-hämmare med en unik verkningsmekanism som hämmar både IL-12, IL-23 och typ 1 IFN-signalvägarna, kan bli ett värdefullt oralt behandlingsalternativ för patienter som lever med psoriasis, säger Anna Åleskog, medicinsk direktör på Bristol Myers Squibb i Sverige.
Resultaten presenteras som ”late-breaking abstract” (Session S033 – Late-Breaking Research Abstracts) på 2021 års amerikanska dermatologikongress, American Academy of Dermatology (AAD) Virtual Meeting Experience (VMX). Fullständiga resultat från båda studier kommer att lämnas in till en medicinsk tidskrift för peer review. I november 2020 respektive februari 2021 presenterade Bristol Myers Squibb positiva topline-resultat från studierna POETYK PSO‐1 och POETYK PSO‐2.
Virtuellt investeringsevent
Bristol Myers Squibb är värd för ett virtuellt investeringsevent fredagen den 23 april 2021 kl. 16.30 CET för att diskutera studieresultaten från POETYK PSO‐1 och POETYK PSO‐2, som presenteras på AAD VMX. Företagsrepresentanter kommer ge en överblick över de presenterade resultaten och svara på frågor från investerare och analytiker.
Investerare och allmänheten bjuds in till en webbsändning (direkt) av eventet på http://investor.bms.com. Material relaterade till webbsändningen kommer att finnas tillgängliga på samma webbplats innan eventet startar. En inspelad version av investeringseventet kommer att finnas tillgänglig senare samma dag.
Om deucravacitinib
Deucravacitinib är en oral, selektiv tyrosinkinas 2 (TYK2)-hämmare med en unik verkningsmekanism. Deucravacitinib är den första och enda TYK2-hämmaren som studeras i kliniska studier för flera immunmedierade sjukdomar. Forskare från Bristol Myers Squibb utformade deucravacitinib för att selektivt rikta in sig på TYK2 och därmed hämma signalering av interleukin (IL)‐12, IL‐23 och typ 1-interferon (IFN), som är viktiga cytokiner involverade i patogenesen vid psoriasis. Deucravacitinib uppnår en hög grad av selektivitet genom att unikt binda till den reglerande snarare än den aktiva domänen för TYK2, som skiljer sig strukturellt från de reglerande domänerna för JAK 1, 2 och 3. Vid terapeutiska doser hämmar deucravacitinib inte JAK1, JAK2 eller JAK3. Med anledning av den innovativa utformningen av deucravacitinib, belönades Bristol Myers Squibb med 2019 års Thomas Alva Edison Patent Award för forskningen som ligger till grund för den kliniska utvecklingen av deucravacitinib.
Deucravacitinib studeras för flera immunmedierade sjukdomar, inklusive psoriasis, psoriasis artrit, lupus och inflammatorisk tarmsjukdom. Förutom POETYK PSO‐1 och POETYK PSO‐2, utvärderar Bristol Myers Squibb deucravacitinib i tre andra fas III-studier för psoriasis: POETYK PSO‐3 (NCT04167462); POETYK PSO‐4 (NCT03924427); POETYK PSO‐LTE (NCT04036435). Deucravacitinib är inte godkänt för användning i något land.
Om fas III-studierna POETYK PSO‐1 och POETYK PSO‐2
PrOgram to Evaluate, utvärderar effekten och säkerheten för deucravacitinib, en selektiv TYK2-hämmare (POETYK). PSO‐1 (NCT03624127) och POETYK PSO‐2 (NCT03611751) är globala fas III-studier utformade för att utvärdera säkerhet och effekt av deucravacitinib jämfört med placebo och Otezla (apremilast), med godkänd dos till patienter med måttlig till svår plackpsoriasis. Både POETYK PSO‐1, som registrerade 666 patienter och POETYK PSO-2, som registrerade 1 020 patienter, är randomiserade, dubbelblinda multicenterstudier som utvärderade deucravacitinib (6 mg en gång dagligen) jämfört med placebo och Otezla (30 mg två gånger dagligen). POETYK PSO‐2 inkluderade en randomiserad period med utsättande och återinsättande av behandling efter vecka 24.
De co-primära effektmåtten för både POETYK PSO‐1 och POETYK PSO‐2 var andelen patienter som uppnådde Psoriasis Area and Severity Index (PASI) 75 och de som uppnådde static Physician Global Assessment-poäng (sPGA) 0 eller 1 vid vecka 16 jämfört med placebo. Viktiga sekundära effektmått i studierna inkluderade andelen patienter som uppnådde PASI 75 och sPGA 0/1 jämfört med Otezla vid vecka 16 och andra mått.
Om psoriasis
Psoriasis är en vanlig, kronisk, immunmedierad systemsjukdom som betydligt försämrar patienters fysiska hälsa, livskvalitet och arbetsproduktivitet. Psoriasis är ett allvarligt globalt problem, där minst 100 miljoner människor världen över drabbas av sjukdomen i någon form. I Sverige uppskattas cirka 250 000 personer ha psoriasis. Upp till 90 procent av patienter med psoriasis har psoriasis vulgaris eller plackpsoriasis, som kännetecknas av runda eller ovala fläckar (plack) som ofta täcks av vita eller silverglänsande fjäll. Trots tillgången till effektiv systembehandling förblir många patienter med måttlig till svår psoriasis underbehandlade, eller till och med obehandlade, och de är missnöjda med nuvarande behandlingar. Personer med psoriasis upplever en negativ påverkan på deras psykiska välbefinnande gällande både personliga och professionella relationer som resulterar i försämrad livskvalitet. Psoriasis är förknippat med ytterligare sjukdomstillstånd som kan påverka patienternas välmående, inklusive psoriasisartrit, hjärt- och kärlsjukdom, metabola syndromet, fetma, diabetes, inflammatorisk tarmsjukdom och depression.
Bristol Myers Squibb – genom forskning och vetenskap förändrar vi patienters liv
På Bristol Myers Squibb inspireras vi av en enda vision – att förändra patienters liv genom forskning och vetenskap. Målet med vår forskning är att förbättra livskvaliteten och den långsiktiga överlevnaden för patienter och att göra bot möjligt. Vi har under lång tid tillhandahållit ett brett spektrum av behandlingar till patienter och som för många har förändrat den förväntade överlevnaden. Vår forskning fokuserar på att studera nya områden inom precisionsmedicin och den personcentrerade vården för att med hjälp av innovativa digitala plattformar analysera data och generera nya kunskaper och öka träffsäkerheten i behandlingarna ytterligare. Vår djupa vetenskapliga expertis, avancerade teknologier och forskningsplattformar gör det möjligt att belysa sjukdomar från alla vinklar. Ett sjukdomstillstånd kan påverka stora delar av patientens liv och Bristol Myers Squibb vill bidra till alla delar av vårdkedjan, från diagnos till att leva med sin sjukdom eller som överlevare. Vi arbetar för att ge människor med svåra sjukdomstillstånd hopp och en bättre framtid. För mer information se www.bms.com/se. Följ oss på LinkedIn #BMSSverige och Twitter @BMSSverige
Celgene och Juno Therapeutics är helägda dotterbolag till Bristol-Myers Squibb Company. I vissa länder med hänsyn till lokal lagstiftning benämns de två dotterbolagen som företag inom Bristol Myers Squibb-koncernen.
Otezla® (apremilast) är ett registrerat varumärke som tillhör Amgen Inc.
Ämnen
Kategorier
Om Bristol Myers Squibb
Bristol Myers Squibb är ett globalt biopharmaföretag som verkar för att upptäcka, utveckla och leverera innovativa mediciner som hjälper patienter att övervinna allvarliga sjukdomar.
För mer information se www.bms.com/se. Följ oss på LinkedIn #BMSSverige och Twitter @BMSSverige
Celgene och Juno Therapeutics är helägda dotterbolag till Bristol-Myers Squibb Company. I vissa länder med hänsyn till lokal lagstiftning benämns de två dotterbolagen som företag inom BMS-koncernen.

